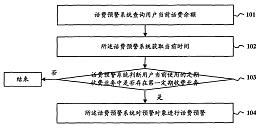
药品技术转让是医药行业优化资源配置、促进创新成果转化的重要途径。随着药品审评审批制度改革的深入推进,国家药品监管部门对药品技术转让的相关规定进行了修订与完善,旨在进一步规范转让行为,保障药品安全、有效和质量可控。以下对新版药品技术转让的核心规定进行解读,并分析其对行业带来的影响。
一、新版规定的主要变化
- 强调主体责任:新规进一步明确了转让方与受让方在药品技术转让全过程的质量主体责任。要求双方必须建立完整的质量管理体系,确保技术转移过程中药品处方、工艺、质量标准等关键信息的真实、准确与完整,且具备相应的生产与质量控制能力。
- 优化审评流程:简化了部分情形的审评程序,例如对于不改变药品处方、工艺、质量标准的简单变更类技术转让,审批时限有望缩短。但加强了对高风险品种、生物制品等的技术审查,体现了“宽进严管”与风险分级管理的思路。
- 强化过程监管与衔接:新规更注重技术转让过程中的动态监管。要求技术转让的申请必须与药品生产许可证变更、GMP符合性检查等环节紧密衔接。受让方必须在获得相关生产资质并通过现场核查后,方可获得批准。这杜绝了“纸上转让”或资质不全即进行生产的风险。
- 明确知识产权要求:明确规定进行转让的药品技术必须具有清晰、合法的知识产权归属,避免产权纠纷。鼓励真正的创新技术转让,抑制低水平重复和单纯“文号买卖”行为。
- 扩展适用范围与细化分类:规定对原料药、制剂、中药、生物制品等的技术转让要求进行了更细致的分类管理,对不同类别产品的技术资料要求、验证工作等提出了更具针对性的标准。
二、对行业的影响与启示
- 促进行业整合与升级:更严格的主体责任和过程监管,提高了技术转让的门槛。这将促使资源向具有真正技术实力、质量体系和产能优势的企业集中,加速行业洗牌与集约化发展,淘汰落后产能。
- 鼓励以价值为导向的创新:政策引导技术转让聚焦于具有临床价值和技术壁垒的创新药、改良型新药以及市场急需的品种。单纯为了获得批文而进行的转让空间被压缩,企业需要更专注于研发具有核心竞争力的产品。
- 提升全链条质量管理意识:新规将技术转让从一个“文件审批”事件,提升为一个涉及研发、生产、质量、法规等多部门协作的系统工程。企业必须建立覆盖药品全生命周期的质量管理体系,才能顺利完成技术转移并保障后续产品的持续稳定生产。
- 规范交易市场,保护合法权益:明确的知识产权要求为技术交易提供了法律保障,有利于构建更加公平、透明、有序的技术交易市场环境,保护创新者的积极性。
三、企业的应对策略
面对新规,药品生产企业应:
- 提前规划,系统评估:在启动转让前,对自身的技术承接能力、产能匹配度、质量体系进行系统性评估与升级。
- 注重过程,夯实基础:高度重视技术转移过程中的工艺验证、稳定性研究等关键工作,确保技术资料的可转移性和可重现性。
- 加强合规,专业运作:组建或依托专业的注册与项目管理团队,深入理解法规要求,确保申报资料的真实、完整与合规,顺畅对接监管流程。
新版药品技术转让规定是深化药品监管改革、促进产业高质量发展的重要举措。其核心在于通过科学监管,引导药品技术有序流动,最终目标是保障公众用药安全,并推动中国医药产业从“大”到“强”的转型升级。相关企业唯有主动适应、苦练内功,方能在新的政策环境下把握机遇,实现可持续发展。